 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
下列行政复议情形中,需终止行政复议的是()。A.行政复议申请受理后,发现其他复议机关已经先于本
下列行政复议情形中,需终止行政复议的是()。
A.行政复议申请受理后,发现其他复议机关已经先于本机关受理的
B.因不可抗力,致使复议机关暂时无法调查了解情况的
C.申请人申请停止执行,复议机关认为其要求合理的
D.申请人要求被申请人履行法定职责,被申请人正在履行的
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
下列行政复议情形中,需终止行政复议的是()。
A.行政复议申请受理后,发现其他复议机关已经先于本机关受理的
B.因不可抗力,致使复议机关暂时无法调查了解情况的
C.申请人申请停止执行,复议机关认为其要求合理的
D.申请人要求被申请人履行法定职责,被申请人正在履行的
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 更多“下列行政复议情形中,需终止行政复议的是()。A.行政复议申请…”相关的问题
更多“下列行政复议情形中,需终止行政复议的是()。A.行政复议申请…”相关的问题
第1题
根据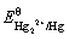 和Hg2Cl2的Ksp,计算
和Hg2Cl2的Ksp,计算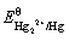 。如溶液中Cl-浓度为0.010mol·L-1,Hg2Cl2/Hg电对的电势为多少?
。如溶液中Cl-浓度为0.010mol·L-1,Hg2Cl2/Hg电对的电势为多少?
第2题
第4题
已知EΘ(Hg22+/Hg)=0.796V,Hg2Cl2(S)的溶度积为1.43×10-18,计算EΘ(Hg2Cl2/Hg)。若溶液中Cl-浓度为0.0100mol.L-1,电对Hg2CI2/Hg的电势为多少?
第5题
A.0.324V
B.1.26V
C.0.144V
D.-0.324V
第6题
A.0.324
B.1.26
C.0.144
D.-0.324
第7题
A.0.026
B.-0.026
C.0.383
D.-0.383
第8题
25℃时,电池Pt|H2(g,100kPa)|HCl(aq)|Hg2Cl2(s)|Hg(1)的电池电动势E=0.4119V,已知EΘ[Hg2Cl2(s)/Hg]=0.2682V。写出该电池的电极反应和电池反应并计算该HCl的溶液浓度。


为了保护您的账号安全,请在“上学吧”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 上学吧
上学吧



 微信搜一搜
微信搜一搜
 上学吧
上学吧