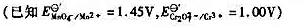题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
化学耗氧量(COD)的测定。今取废水样100mL用H2</sub>S04</sub>酸化后,加入25mL,0.01667mol·L-1⊕
化学耗氧量(COD)的测定。今取废水样100mL用H2S04酸化后,加入25mL,0.01667mol·L-1K2Cr2O7溶液,以Ag2SO4为催化剂,煮沸一定时间, 待水样中还原性物质较完全地氧化后,以邻二氮菲-亚铁为指示剂,用0.100mol·L-1FeSO4溶液滴定剩余的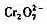 ,用去15.00mL。计算废水样中化学耗氧量,以mg·L-1表示。
,用去15.00mL。计算废水样中化学耗氧量,以mg·L-1表示。
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案


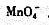 及
及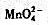 歧化生成的
歧化生成的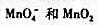 全部还原至Mn2+,剩余的Fe2+溶液用上述KMnO4标准溶液滴定,至终点时消耗24.00mL。计算试液中HC00H和HAc的浓度各为多少?
全部还原至Mn2+,剩余的Fe2+溶液用上述KMnO4标准溶液滴定,至终点时消耗24.00mL。计算试液中HC00H和HAc的浓度各为多少?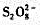 把Cr3+氧化为
把Cr3+氧化为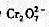 ,煮沸,除去多余的
,煮沸,除去多余的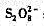 ;加入
;加入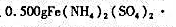 ,
,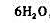 把
把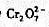 还原为Cr3+,多余的Fe2+被0.00389mol·L-1的K2Cr2O7返滴定,达到终点时共用去K2Cr2O7,18.29mL。试确定铬板的平均厚度。已知Cr的密度为7.20g/cm3。
还原为Cr3+,多余的Fe2+被0.00389mol·L-1的K2Cr2O7返滴定,达到终点时共用去K2Cr2O7,18.29mL。试确定铬板的平均厚度。已知Cr的密度为7.20g/cm3。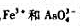 都能氧化I+而干扰铜的测定,加入0.005mol·L-1NH4HF2即能消除
都能氧化I+而干扰铜的测定,加入0.005mol·L-1NH4HF2即能消除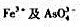 的干扰。试以计算说明之。
的干扰。试以计算说明之。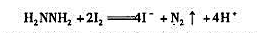 ,再用过量的Br2氧化,除去剩余的Br2后加入过量KI,酸化,以淀粉作指示剂,用Na2S2O3标准溶液滴定,求得I2的含量。
,再用过量的Br2氧化,除去剩余的Br2后加入过量KI,酸化,以淀粉作指示剂,用Na2S2O3标准溶液滴定,求得I2的含量。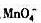 可以用作分析Mn2+的滴定剂,待测组分和滴定剂的产物均为MnO2。在一锰的矿物分析中,0.5165g试样被溶解,然后Mn被还原为Mn2+,碱化该溶液并用0.03358mol·L-1的KMnO4滴定该溶液,达到滴定终点时需要34.88mLKM4计算矿物中Mn的含量。
可以用作分析Mn2+的滴定剂,待测组分和滴定剂的产物均为MnO2。在一锰的矿物分析中,0.5165g试样被溶解,然后Mn被还原为Mn2+,碱化该溶液并用0.03358mol·L-1的KMnO4滴定该溶液,达到滴定终点时需要34.88mLKM4计算矿物中Mn的含量。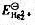 和Hg2Cl2的Kap ,计算
和Hg2Cl2的Kap ,计算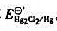 如溶液中Cl-浓度为0.010mol·L-1,Hg2Cl2/Hg电对的电势为多少?
如溶液中Cl-浓度为0.010mol·L-1,Hg2Cl2/Hg电对的电势为多少?