 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
有25.00ml浴液,用10.00mL的0.0500mol·L-1</sup>KIO3</sub>溶液处理后,煮沸溶液以除去12。冷却后,加入过量KI溶液使之与剩余的KIO3</sub>反应,然后将溶液调至中性。析出的I2用0.1008moL·L-1</sup>Na2</sub>S2</sub>O2</sub>溶液滴定,用去21
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 更多“有25.00ml浴液,用10.00mL的0.0500mol·…”相关的问题
更多“有25.00ml浴液,用10.00mL的0.0500mol·…”相关的问题
第1题
少量的碘化物可利用“化学放大”反应进行测定,其步骤如下:在中性或弱酸性介质中先加Br2然后加入过量的KI,用CCL4萃取生成的I2(萃取率E=100% )。分去水相后,用肼(即联氨)的水溶液将I2反萃至水相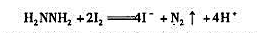 ,再用过量的Br2氧化,除去剩余的Br2后加入过量KI,酸化,以淀粉作指示剂,用Na2S2O3标准溶液滴定,求得I2的含量。
,再用过量的Br2氧化,除去剩余的Br2后加入过量KI,酸化,以淀粉作指示剂,用Na2S2O3标准溶液滴定,求得I2的含量。
a.写出上述过程的有关反应方程式;
b.根据有关的反应计量关系,说明经上述步骤后,试样中1mol的I可消耗几摩尔Na2S2O3相当于“放大”到多少倍?
c.若在测定时,准确移取含KI的试液25.00mL。终点时耗用0.100mol·1L-1Na2S2O3溶液20.06mL,试计算试液中KI的浓度(g.L-1)。已知MKI=166g·mol-1
请帮忙给出正确答案和分析,谢谢!
第2题
在碱性条件下,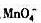 可以用作分析Mn2+的滴定剂,待测组分和滴定剂的产物均为MnO2。在一锰的矿物分析中,0.5165g试样被溶解,然后Mn被还原为Mn2+,碱化该溶液并用0.03358mol·L-1的KMnO4滴定该溶液,达到滴定终点时需要34.88mLKM4计算矿物中Mn的含量。
可以用作分析Mn2+的滴定剂,待测组分和滴定剂的产物均为MnO2。在一锰的矿物分析中,0.5165g试样被溶解,然后Mn被还原为Mn2+,碱化该溶液并用0.03358mol·L-1的KMnO4滴定该溶液,达到滴定终点时需要34.88mLKM4计算矿物中Mn的含量。
请帮忙给出正确答案和分析,谢谢!
第4题
分别计算0.100mol·L-1KMnO4和0.100mol·L-1K2Cr2O2在H+浓度为1.0mol·L-1介质中,还原一半时的电势。计算结果说明什么?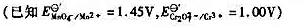
请帮忙给出正确答案和分析,谢谢!


为了保护您的账号安全,请在“上学吧”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 上学吧
上学吧



 微信搜一搜
微信搜一搜
 上学吧
上学吧