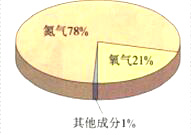
题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
题目来源:1月6日下午云南省昭通市面试考题试讲题目1.题目:酯化反应2.内容:乙酸和乙醇在浓硫酸存
题目来源:1月6日下午云南省昭通市面试考题
试讲题目
1.题目:酯化反应
2.内容:
乙酸和乙醇在浓硫酸存在下可以反应生成有浓郁香味、不易溶于水的油状液体——乙酸乙酯。
科学实验证明,乙酸乙酯是乙醇分子中的乙氧基(CH3CH2O-)取代了乙酸分子中羧基上的羟基(-OH)的生成物,即乙醇分子和乙酸分子间脱去一个水分子的产物。反应的化学方程式可表示为:

像这种醇和酸作用生成酯和水的反应叫做酯化反应seterification reaction)。
官能团
甲醇、乙醇分子中含有羟基(-OH),乙酸、高级脂肪酸分子中含有羧基(-COOH),甲醛、乙醛分子中含有醛基(-CHO)。这些基团反映了一类有机化合物的共同特性,叫做官能团(functional group)。
3.基本要求:
(1)根据上述片段,简要写出试讲提纲(要求试讲结束后上交)。
(2)试讲时间控制在10分钟左右。
(3)试讲中要有课堂提问。
(4)试讲时要有必要的板书。
(5)试讲中涉及到的实验及其他教学媒体只需用语言进行情景模拟即可。
答辩题目
1.教学重难点是什么?
2.酯化反应生成的水分子里的氧原子是由醇提供还是酸提供?在科学上怎样给予肯定?
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案







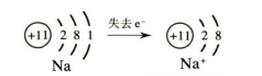


 五氧化二磷
五氧化二磷