 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
利用标准电极电势数据判断H2S、SO2、SnCl2和金属铝能否把TiO2+抖还原成Ti3+。
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 更多“利用标准电极电势数据判断H2S、SO2、SnCl2和金属铝能…”相关的问题
更多“利用标准电极电势数据判断H2S、SO2、SnCl2和金属铝能…”相关的问题
第1题
试利用标准电极电势的数据(表5.5)计算298K时反应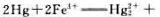
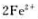 的平衡常数
的平衡常数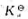 .
.
第3题
利用附录C.2已知的
 数据,求下列电极反应的标准电极电势: (1)ClO3-+6H++6e=Cr-+3H2O (2)H2O2+2H++2e=2H2O
数据,求下列电极反应的标准电极电势: (1)ClO3-+6H++6e=Cr-+3H2O (2)H2O2+2H++2e=2H2O
第4题
将下列氧化还原反应设计成为两个半电池反应,并利用标准电极电势表的数据,求出298K时反应的平衡常数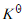 。
。
第6题
A.所有电对的标准电极电势都可以与标准氢电极构成原电池而测到。
B.标准电极电势的数值与电对得失电子数有关系。
C.可以根据标准电极电势的数值判断物质的氧化性和还原性的相对强弱。
D.标准电极电势与温度无关。
第7题
利用 的K=1014和Ag2CrO4的溶度积以及Ag++e-=Ag的标准电极电势求2Ag2CrO4+2H+-4e-=4Ag++Cr2O72-+H2O的标准电极电势。
的K=1014和Ag2CrO4的溶度积以及Ag++e-=Ag的标准电极电势求2Ag2CrO4+2H+-4e-=4Ag++Cr2O72-+H2O的标准电极电势。
第9题
利用半反应 和
和 的标准电极电势(-0.065V)计算配合反映
的标准电极电势(-0.065V)计算配合反映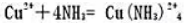 的平衡常数。
的平衡常数。


为了保护您的账号安全,请在“上学吧”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 上学吧
上学吧



 微信搜一搜
微信搜一搜
 上学吧
上学吧