 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
298K时,已知如下电池的标准电动势=0.2680V: Pt|H2()|HCl(0.08mol·kg-1, γ±=0.809)|Hg2Cl2(s)|Hg(l)
298K时,已知如下电池的标准电动势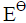 =0.2680V:
=0.2680V:
Pt|H2(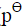 )|HCl(0.08mol·kg-1, γ±=0.809)|Hg2Cl2(s)|Hg(l)
)|HCl(0.08mol·kg-1, γ±=0.809)|Hg2Cl2(s)|Hg(l)

 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
298K时,已知如下电池的标准电动势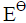 =0.2680V:
=0.2680V:
Pt|H2(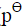 )|HCl(0.08mol·kg-1, γ±=0.809)|Hg2Cl2(s)|Hg(l)
)|HCl(0.08mol·kg-1, γ±=0.809)|Hg2Cl2(s)|Hg(l)

 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 更多“298K时,已知如下电池的标准电动势=0.2680V: Pt…”相关的问题
更多“298K时,已知如下电池的标准电动势=0.2680V: Pt…”相关的问题
第2题
试设计合适的电池判断在298K时,将金属银插在碱溶液中,在通常的空气中银是否会被氧化(空气中氧气分压为21kPa)?如果在溶液中加入大量的CN-,情况叹怎样?已知:
[Ag(CN)2]-+e-====Ag(s)+2CN-,![]() =-0.31V
=-0.31V
第4题
在298K时,有电池:Ag(s)|AgCl(s)|NaCl(aq)|Hg2Cl2(s)|Hg(l)。已知化合物的标准生成Gibbs自由能分别为(AgCl,s)=-109.79kJ·mol-1,
(Hg2Cl2,s)=-210.75kJ·mol-1。试写出该电池的电极和电池反应,并计算电池的电动势。


为了保护您的账号安全,请在“上学吧”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 上学吧
上学吧



 微信搜一搜
微信搜一搜
 上学吧
上学吧