 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
如图6.3.10所示电路,已知iS=[5+10cos(10t-20°)-5sin(30t+60°)]A,L1=L2=2H,M=0.5H,求图中电流表的读数和u2。
如图6.3.10所示电路,已知iS=[5+10cos(10t-20°)-5sin(30t+60°)]A,L1=L2=2H,M=0.5H,求图中电流表的读数和u2。
![如图6.3.10所示电路,已知iS=[5+10cos(10t-20°)-5sin(30t+60°)]](https://img2.soutiyun.com/ask/uploadfile/5385001-5388000/90b0f95d0b11effa35795cd323cebe35.png)
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
如图6.3.10所示电路,已知iS=[5+10cos(10t-20°)-5sin(30t+60°)]A,L1=L2=2H,M=0.5H,求图中电流表的读数和u2。
![如图6.3.10所示电路,已知iS=[5+10cos(10t-20°)-5sin(30t+60°)]](https://img2.soutiyun.com/ask/uploadfile/5385001-5388000/90b0f95d0b11effa35795cd323cebe35.png)
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 更多“如图6.3.10所示电路,已知iS=[5+10cos(10t…”相关的问题
更多“如图6.3.10所示电路,已知iS=[5+10cos(10t…”相关的问题
第1题
已知四氧化二氮的分解反应为N2O4(g)===2NO2(g)。在298.15K时,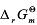 =4.75kJ·mol-1。试判断在此温度及下列条件下,反应进行的方向。
=4.75kJ·mol-1。试判断在此温度及下列条件下,反应进行的方向。
(1)N2O4(g,100kPa),NO2(g,100kPa);
(2)N2O4(g,1000kPa),NO2(g,100kPa);
(3)N2O4(g,300kPa),NO2(g,200kPa)。
第2题
A.左
B.右
C.达到平衡
D.无法确定
第3题
N2O5(g)→N2O4(g)+(1/2)O2(g)为一级反应。在25℃时,反应速率常数为0.0010min-1。同温度下产物N2O4能分解成NO2(g),并很快达平衡:N2O4(g) 2NO2(g),反应平衡常数
2NO2(g),反应平衡常数。今在25℃将压力为26.65kPa的N2O5置于一真空容器中,试求200min时容器中N2O5、O2、N2O4和NO2的分压力。
第5题
已知四氧化二氮的分解反应:N2O4(g)====2NO2(g)
在298.15K时, =2.8kJ·mol-1。试判断在此温度及下列条件下,反应进行的方向。
=2.8kJ·mol-1。试判断在此温度及下列条件下,反应进行的方向。

第6题
恒温下,在反应2NO2(g)=N2O4(g)达到平衡后的体系中加入惰性气体,则平衡不移动。()


为了保护您的账号安全,请在“上学吧”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 上学吧
上学吧



 微信搜一搜
微信搜一搜
 上学吧
上学吧