 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)


[单选题]
某氢电极与饱和甘汞电极(
某氢电极与饱和甘汞电极(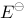 =+0.240 v)组成原电池 ,若要使电池电动势达到 +0.299 v ,则溶液的 pH 值是
=+0.240 v)组成原电池 ,若要使电池电动势达到 +0.299 v ,则溶液的 pH 值是
A.1
B.2
C.3
D.4
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)


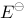 =+0.240 v)组成原电池 ,若要使电池电动势达到 +0.299 v ,则溶液的 pH 值是
=+0.240 v)组成原电池 ,若要使电池电动势达到 +0.299 v ,则溶液的 pH 值是
A.1
B.2
C.3
D.4
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 更多“某氢电极与饱和甘汞电极( =+0.240 v)组成原电池 ,…”相关的问题
更多“某氢电极与饱和甘汞电极( =+0.240 v)组成原电池 ,…”相关的问题
第1题
将一支选择电极插入50.00mL某高氯酸盐待测溶液,与饱和甘汞电极(为负极)组成电池。25℃时测得电动势358.7mV,加入1.00mL NaClO4标准溶液(0.0490mol/L)后,电动势变成346.1mV。求待测溶液中浓度。

第2题
用Cl-选择性电极作负极,饱和甘汞电极作正极组成电池测定某溶液中氯化物含量。取100mL此溶液在25℃时测得电池电动势为28.8mV。加入1.00mL浓度为0.475mol·L-1的经酸化的NaCl标准溶液后,测得电池电动势为53.5mV。求该溶液中氯化物浓度。
第3题
第4题
第5题
已知某原电池的正极是氢电极,p(H2)为100kPa,负极的电极电势是恒定的。当氢电极中pH=4.008时,该电池的电动势是0.412V。如果氢电极中所用的溶液改为一未知c(H+)的缓冲溶液,又重新测得原电池的电动势为0.427V。计算该缓冲溶液的H+浓度和pH值。如该缓冲溶液中c(HA)=c(A-)=1.0mol·dm-3,求该弱酸HA的电离常数。
第6题
任何电极电势绝对值都不能直接测定,在理论上,某电对的标准电极电势![]() 是将其与______电极组成原电池测定该电池的电动势而得到的电极电势的相对值。在实际测定中常以______电极为参比电极,与待测电极组成原电池测定之。
是将其与______电极组成原电池测定该电池的电动势而得到的电极电势的相对值。在实际测定中常以______电极为参比电极,与待测电极组成原电池测定之。
第7题
第8题


为了保护您的账号安全,请在“上学吧”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 上学吧
上学吧



 微信搜一搜
微信搜一搜
 上学吧
上学吧