 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
求箅25℃时,Ag-AgCl电极在AgC1溶液中(m1=10-5mol·kg-1)及在NaCl溶液中(m2
求箅25℃时,Ag-AgCl电极在AgC1溶液中(m1=10-5mol·kg-1)及在NaCl溶液中(m2=0.01mol·kg-1,y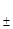 =0.889),电极电势之差为若干?
=0.889),电极电势之差为若干?
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
求箅25℃时,Ag-AgCl电极在AgC1溶液中(m1=10-5mol·kg-1)及在NaCl溶液中(m2=0.01mol·kg-1,y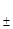 =0.889),电极电势之差为若干?
=0.889),电极电势之差为若干?
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 更多“求箅25℃时,Ag-AgCl电极在AgC1溶液中(m1=10…”相关的问题
更多“求箅25℃时,Ag-AgCl电极在AgC1溶液中(m1=10…”相关的问题
第1题
25℃时,电池Ag-AgCl(s)|KBr(m)|Br2(l)(Pt)的E=0.9940V,溴在溴化钾溶液上的平衡蒸汽压为2.126×104Pa,已知![]() (AgBrlAg)=0.071V,求电极(Pt)Br2(pθ)|Br-的
(AgBrlAg)=0.071V,求电极(Pt)Br2(pθ)|Br-的![]() ·
·
第2题
第4题

在25℃时。当标准缓冲溶液的pH=4.006,测得其中动势为-0.2094V。用一种未知pH的缓冲溶液代替上述已知pH的缓冲溶液,所测电动势值为-0.2806V,计算这种缓冲溶液的pH。
第5题
(2)假设各离子的活度因子等于1.若实验开始时将过量Ag放入0.100mol·kg-1的Fe(NO3)3溶液中进行反应,求平衡时溶液中Ag+的液度
第9题
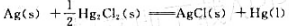
已知25℃时,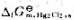 =-210.7kJ·mol-1,
=-210.7kJ·mol-1,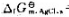 =-109.7kJ·mol-1,请:
=-109.7kJ·mol-1,请:
(1)试为上述反应设计一可逆电池,写出电池表示式和电极反应;
(2)求所设计电池的电动势及其温度系数和电池反应的ΔtGmθ、ΔtSmθ:
(3)求25℃时,电极C1-|Hg2Cl2|Hg的标准电极电位;
已知25℃时,Eθ[Ag+|AgCl(s)|Ag]=0.2224V
(4)已知25℃时Eθ(Hg22+|Hg)=0,798V,求Hg2Cl2在25℃时的溶度积.
第10题
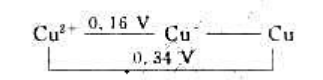
(1)试计算25℃时电对Cu2+/Cu的标准电极电势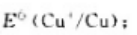
(2)已知2.303RT/F=0.060V,试计算25℃时Cu2+的歧化反应的标准平衡常数,


为了保护您的账号安全,请在“上学吧”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 上学吧
上学吧



 微信搜一搜
微信搜一搜
 上学吧
上学吧