 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
计算pH10.0,在总浓度为0.1mol•L-1NH3-NH4Cl缓冲溶液中,Ag+/Ag电对的条件电势。忽略离子强度及形
计算pH10.0,在总浓度为0.1mol•L-1NH3-NH4Cl缓冲溶液中,Ag+/Ag电对的条件电势。忽略离子强度及形成[AgCl2]-配位化合物的影响。已知Ag-NH3配位化合物的lgβ1~lgβ2分别为3.24、7.05;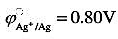 。
。
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
计算pH10.0,在总浓度为0.1mol•L-1NH3-NH4Cl缓冲溶液中,Ag+/Ag电对的条件电势。忽略离子强度及形成[AgCl2]-配位化合物的影响。已知Ag-NH3配位化合物的lgβ1~lgβ2分别为3.24、7.05;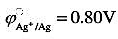 。
。
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 更多“计算pH10.0,在总浓度为0.1mol•L-1NH3-NH…”相关的问题
更多“计算pH10.0,在总浓度为0.1mol•L-1NH3-NH…”相关的问题
第1题
第2题
称取含抗生素对氨基苯磺酰胺(以sul简称)的粉末试样0.2981g,溶于盐酸并稀释至100.0mL。分取20.00mL置一锥形瓶中,加入25.00mL0.01767mol/L的KBrO3及过量的KBr。密封,10min后确保完成了相应的溴化反应。加入过量KI,析出的[I3]-需12.92mL0.1215mol/L的Na2S2O3溶液滴定(以淀粉为指示剂)。已知Msul=172.21g/mol。
a.写出sul的分子结构式;
b.写出酸性溶液中KBrO3与KBr反应的离子方程式;
c.写出sul与Br2的溴化反应方程式;
d.计算此粉末试样中的sul的质量分数;
请帮忙给出正确答案和分析,谢谢!
第3题
在酸性介质中,用0.1000mol/L(1/5)KMnO4滴定0.1000mol/L(1/2)U4+。设化学计量点的[H+]=1.00。
(1)试写出滴定反应的离子反应式;
(2)如用KMnO4的本色确定终点不太明显,还有何种方法可以指示终点?
(3)已知
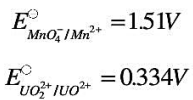 ,
,
试推导并计算化学计量点的电位。
请帮忙给出正确答案和分析,谢谢!
第4题


为了保护您的账号安全,请在“上学吧”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 上学吧
上学吧



 微信搜一搜
微信搜一搜
 上学吧
上学吧