题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知CO2(g)的临界温度、临界压力和临界摩尔体积分别为Te =304.3 K,pe=73.8×105Pa,Vm,c=0. 09
已知CO2(g)的临界温度、临界压力和临界摩尔体积分别为Te =304.3 K,pe=73.8×105Pa,Vm,c=0. 0957dm3·mol-1。(1) 试计算CO2(g)的van der Waals常数a.b的值;(2) 313K时,在容积为0.005m3的容器内含有0.1kgCO2(g),用vanderWaals方程计算气体的压力;(3)在与(2)相同的条件下,用理想气体状态方程计算气体的压力。
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案


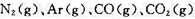 的摩尔分数(空气中各气体的摩尔分数为
的摩尔分数(空气中各气体的摩尔分数为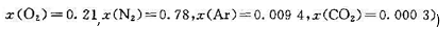 , );(3)每燃烧1 kg的炭,计算可得20℃、100 kPa下的发生炉煤气的体积。
, );(3)每燃烧1 kg的炭,计算可得20℃、100 kPa下的发生炉煤气的体积。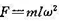 ,m为质点的质量,l是中心与管端的距离, 是质点的角速度。)
,m为质点的质量,l是中心与管端的距离, 是质点的角速度。)