 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
常温下,将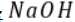 溶液滴加到
溶液滴加到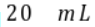 等浓度的某一元酸(HA)溶液中,测得混合溶液的pH与微粒浓度变化关系如图所示[已知:
等浓度的某一元酸(HA)溶液中,测得混合溶液的pH与微粒浓度变化关系如图所示[已知: ]。下列说法错误的是()。
]。下列说法错误的是()。
A.
m点对应的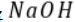 溶液体积小于
溶液体积小于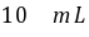
B.
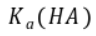 的数量级为
的数量级为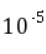
C.
l点所示溶液中:
D.n、m、l三点,n点水的电离程度最大
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
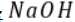 溶液滴加到
溶液滴加到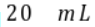 等浓度的某一元酸(HA)溶液中,测得混合溶液的pH与微粒浓度变化关系如图所示[已知:
等浓度的某一元酸(HA)溶液中,测得混合溶液的pH与微粒浓度变化关系如图所示[已知: ]。下列说法错误的是()。
]。下列说法错误的是()。
A.
m点对应的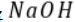 溶液体积小于
溶液体积小于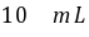
B.
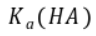 的数量级为
的数量级为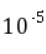
C.
l点所示溶液中:
D.n、m、l三点,n点水的电离程度最大
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 更多“常温下,将溶液滴加到等浓度的某一元酸(HA)溶液中,测得混合…”相关的问题
更多“常温下,将溶液滴加到等浓度的某一元酸(HA)溶液中,测得混合…”相关的问题
第1题
A.电离常数:Ka(HB)>Ka(HA)
B.Ka(HA)的数量级为10-5
C.当HA与NaOH溶液混合至中性时:c(A-)=c(HA)
D.等浓度等体积的HA和NaB混合后所得溶液中:c(H+)>c(OH-)
第2题
A.Ka2(H2X)的数量级为10–6
B.曲线N表示pH与 的变化关系
C.NaHX溶液中
D.当混合溶液呈中性时
第3题
A.Ka2(H2X)的数量级为10-6
B.曲线N表示pH与lg的变化关系
C.NaHX溶液中c(H+)>c(OH-)
D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+)
第4题
A.向HB溶液中滴加NaOH溶液的过程中,水的电离程度一直增大
B.用pH为11的某碱与pH为3的HB溶液等体积混合后,溶液不可能显碱性
C.氨水与HA溶液混合后的溶液中可能存在:c(NH)>c(A-)>c(H+)>c(OH-)
D.完全中和等体积、等pH的HA、HB两溶液时,消耗同浓度NaOH溶液的体积:HA<HB
第5题
某化学小组设计了如图甲所示的数字化实验装置,研究常温下,向1L0.1mol/LH2A溶液中逐滴加入等浓度NaOH溶液时的pH变化情况,并绘制出溶液中含A元素的粒子的物质的量分数与溶液pH的关系如图乙所示,则下列说法中正确的是()。
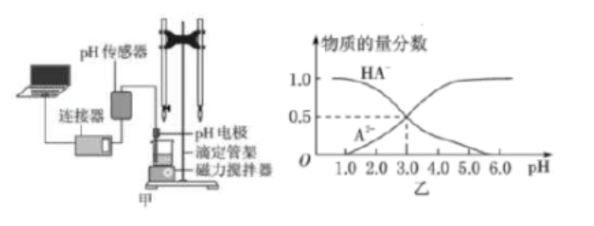
A.pH=4.0时,图中n(HA)约为0.0091mol
B.0.1mol/LNaHA溶液中存在c(A3)+c(HA)+c(H2A)=O.1mol/L
C.该实验应将左边的酸式滴定管换成右边碱式滴定管并加酚酞作指示剂
D.常温下,等物质的量浓度的NaHA与Na2A溶液等体积混合后溶液pH=3.0
第6题
第7题
A.当pH=3时,溶液中c(HC2)<c(C2)=c(H2C2O4)
B.pH由3增大到5.3的过程中,水的电离程度逐渐减小
C.常温下,Ka2=10-5.3
D.常温下随着pH的增大:c2(HC2)/[c(H2C2O4)·c(C2)]的值先增大后减小
第8题
B.由pH=3的HA溶液与pH=11的NaOH溶液等体积混合,所得溶液中:c(Na+)>c(A-)>c(OH-)>c(H+)
C.浓度均为0.1 mol·L-1的HA和NaA溶液等体积混合,所得溶液中:c(A-)>c(HA)>c(Na+)>c(OH-)>c(H+)
D.0.1 mol·L-1 HA溶液与0.05 mol·L-1 NaOH溶液等体积混合,所得溶液中 :2c(H+)+c(HA)===c(A-)+2c(OH-)
第9题
B.由pH=3的HA溶液与pH=11的NaOH溶液等体积混合,所得溶液中:c(Na+)>c(A-)>c(OH-)>c(H+)
C.浓度均为0.1 mol·L-1的HA和NaA溶液等体积混合,所得溶液中:c(A-)>c(HA)>c(Na+)>c(OH-)>c(H+)
D.0.1 mol·L-1 HA溶液与0.05 mol·L-1 NaOH溶液等体积混合,所得溶液中 :2c(H+)+c(HA)===c(A-)+2c(OH-)
第10题
A.MOH为强碱,HA为弱酸
B.水的电离程度:X=Y>Z
C.若升高温度,Y、Z点对应溶液的pH值均减小
D.将X点溶液与Z点溶液等体积混合,所得溶液中c(A-)>c(M+)>c(H+)>c(OH-)
第11题
B.由pH=3的HA溶液与pH=11的NaOH溶液等体积混合,所得溶液中:c(Na+)>c(A-)>c(OH-)>c(H+)
C.浓度均为0.1 mol·L-1的HA和NaA溶液等体积混合,所得溶液中:c(A-)>c(HA)>c(Na+)>c(OH-)>c(H+)
D.0.1 mol·L-1 HA溶液与0.05 mol·L-1 NaOH溶液等体积混合,所得溶液中 :2c(H+)+c(HA)===c(A-)+2c(OH-)


为了保护您的账号安全,请在“上学吧”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 上学吧
上学吧



 微信搜一搜
微信搜一搜
 上学吧
上学吧