 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
试设计一个电池,使其中进行下述反应:(1)写出电池表示式;(2)计算25℃时,上述电池反应的Kθ
试设计一个电池,使其中进行下述反应:

(1)写出电池表示式;
(2)计算25℃时,上述电池反应的Kθ;
(3)若将过量的银粉加到浓度为0.05mol·kg-1的Fe(NO3)3溶液中,求反应达平衡后Ag+的浓度为多少?(设活度系数均为1).已知φθ(Fe3+|Fe2+)=0.771V,φθ(Ag|Ag+)=0.7991V.
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
试设计一个电池,使其中进行下述反应:

(1)写出电池表示式;
(2)计算25℃时,上述电池反应的Kθ;
(3)若将过量的银粉加到浓度为0.05mol·kg-1的Fe(NO3)3溶液中,求反应达平衡后Ag+的浓度为多少?(设活度系数均为1).已知φθ(Fe3+|Fe2+)=0.771V,φθ(Ag|Ag+)=0.7991V.
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 更多“试设计一个电池,使其中进行下述反应:(1)写出电池表示式;(…”相关的问题
更多“试设计一个电池,使其中进行下述反应:(1)写出电池表示式;(…”相关的问题
第1题
常用的铅蓄电池可表示为Pb(s)|PbSO4(s)|H2SO4(m=1mol·kg-1)|PbSO4(s)|PbO2(s)|Pb(s)。已知在0~60℃的温度区内,电动势与温度的关系式为
E/V=1.91737+56.1×10-6(t/℃)+1.08×10-8(t/℃)2
在25℃时,电池的摩尔电压=2.041V,试计算这时电解质溶液H2SO4(m=1mol·kg-1)的平均活度因子γ±。
第2题
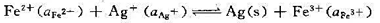
(1)写出电池的表达式;(2)计算上述电池反应在298 K、反应进度为1 mol时的平衡常数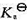 ;(3)若将过量磨细的银粉加到浓度为0.05mol·kg-1的Fe(NO3)3,溶液中,求当反应达平衡后,Ag+的浓度为多少(设活度因子均等于1)?
;(3)若将过量磨细的银粉加到浓度为0.05mol·kg-1的Fe(NO3)3,溶液中,求当反应达平衡后,Ag+的浓度为多少(设活度因子均等于1)?
第4题
第6题
液相反应A+2B→P的反应速率方程为
-rA=kcAcB 式中rA的单位为mol·m-3·h-1
在50℃时的反应速率常数为4.5mol/(m3·h),现将组成为cA0=0.50mol/m3,cB0=0.90mol/m3,cP0=0,温度为50℃的反应原料,以5.0m3/h的流量送入一平推流反应器,使反应在50℃恒温条件下进行。试计算A的转化率为80%时所需的![]()
第7题
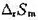 ;(2)当该反应不通过可逆电池完成时,求环境的熵变和隔离系统的总熵变,隔离系统的总熵变值说明了什么问题;(3)计算系统可能做的最大功的值。
;(2)当该反应不通过可逆电池完成时,求环境的熵变和隔离系统的总熵变,隔离系统的总熵变值说明了什么问题;(3)计算系统可能做的最大功的值。


为了保护您的账号安全,请在“上学吧”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 上学吧
上学吧



 微信搜一搜
微信搜一搜
 上学吧
上学吧